Erwärmen, Schmelzen und Kochen von Wasser
Beim Erwärmen von Wasser nehmen die Teilchen Energie auf und bewegen sich schneller.
Die Temperatur steigt dabei kontinuierlich.
Die zugeführte Wärme lässt sich mit dieser Formel berechnen.
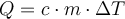
- \(Q\): zugeführte Wärmeenergie
- \(c\): spezifische Wärmekapazität \(c_{Wasser}=4,18 \frac{kJ}{kg\cdot K}\)
- \(m\): Masse des Wassers
- \(\Delta T\): Temperaturänderung
Dabei steht m für die Masse des Wassers, c für die spezifische Wärmekapazität und ΔT für die Temperaturänderung.
\(c_{Wasser}=4,18 \frac{kJ}{kg\cdot K}\)
Erreicht Wasser 0 °C, beginnt Eis zu schmelzen. Während des Schmelzens bleibt die Temperatur konstant, obwohl weiter Energie zugeführt wird. Diese Energie wird genutzt, um die festen Bindungen zwischen den Wasserteilchen zu lösen. Die benötigte Schmelzwärme berechnet man mit
Q = m · s,
wobei s die spezifische Schmelzwärme ist.
\(s_{Wasser}=334 kJ/kg\)
Erreicht flüssiges Wasser 100 °C, beginnt es zu kochen. Auch hier bleibt die Temperatur während des Kochens konstant. Die zugeführte Energie sorgt dafür, dass die Teilchen vollständig in den gasförmigen Zustand übergehen. Die dafür nötige Verdampfungswärme lässt sich mit
Q = m · r
bestimmen, wobei r die spezifische Verdampfungswärme ist.
\(r_{Wasser}=2256 kJ/kg\)
Diese Vorgänge zeigen, dass Temperaturänderung und Zustandsänderung unterschiedliche Arten von Energieaufnahme erfordern.