Lektion 1: Das Ölfilm-Experiment – Wie groß ist ein Molekül?
In diesem Versuch möchten wir abschätzen, wie groß Moleküle sind – und zwar mithilfe eines Tropfens Öl auf Wasser. Aus einem winzig kleinen Tropfen entsteht ein hauchdünner Film, der uns verrät, wie dick (bzw. wie groß) ein einzelnes Molekül ist.
1. Lernziel
- Verstehen, wie man aus einem Ölfilm auf Wasser den Durchmesser eines Moleküls abschätzt.
- Üben, mit einfachen Messwerten und Formeln zu rechnen.
- Ein Gefühl dafür bekommen, wie winzig Atome und Moleküle sind.
2. Hintergrundwissen
- Moleküle sind winzige Teilchen, die sich aus mehreren Atomen zusammensetzen. Ihre Größe liegt im Bereich von 10⁻⁹ bis 10⁻¹⁰ Metern (Nanometerbereich).
- Oktansäure ist eine Fettsäure, die im Wasser einen sehr dünnen Film bildet, weil ihre Moleküle nur eine Lage dick auf der Wasseroberfläche liegen.
3. Materialien
- eine flache Glasschale mit Wasser
- Pipette oder Tropfflasche mit sehr verdünnter Oktansäure-Lösung in flüchtigem Öl
- Lineal
- Bärlappsamen
4. Versuchsdurchführung
Vorbereiten
Fülle das Becherglas zu etwa drei Vierteln mit klarem Wasser und stelle es auf eine ebene Unterlage.
Streue Bärlappsammen auf die Wasseroberfläche.
Tropfen setzen
Tauche die Pipette in die Öl-Lösung und setze einen einzigen Tropfen ganz vorsichtig auf die Wasseroberfläche. Achte darauf, dass keine zusätzlichen Tropfen ins Wasser gelangen!
Film messen
Warte kurz, bis sich das Öl gleichmäßig ausgebreitet hat und einen dünnen, kreisförmigen Film auf dem Wasser bildet. Miss nun den Radius r dieses Ölfilms.
Tropfenvolumen schätzen
Bei winzigeren Tropfen kannst du annehmen, dass ihr Volumen V etwa (0{,}05\;\text{cm}^3) beträgt.
5. Berechnung des Moleküldurchmessers
Fläche des Ölfilms
Ein Kreis mit Radius r hat die Fläche
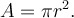
Dicke des Films
Weil der Tropfen sein Volumen V in eine schmale Scheibe umwandelt, gilt
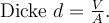
Diese Dicke entspricht annähernd dem Durchmesser eines Moleküls.
Rechenbeispiel
- Gemessener Durchmesser des Ölfilms: \(r = 10{,}0\,\text{cm}\).
Tropfenvolumen: \(V = 0{,}05\,\text{cm}^3\).
Fläche:
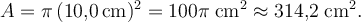
Dicke:
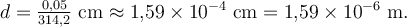
Umgerechnet in Nanometer:
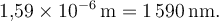
Hinweis: Dieser Wert liegt etwas zu groß, weil unser Tropfenvolumen nur grob geschätzt ist. Typisch für Fettsäuremoleküle ist ein Durchmesser um \(2\,\text{nm}\). Trotzdem: Das Prinzip stimmt!
6. Interpretation und Reflexion
- Dein berechneter „Moleküldurchmesser“ zeigt, dass Moleküle millionenfach kleiner sind als Dinge die wir sonst messen.
- Kleine Fehler in der Volumenschätzung oder der Messung des Durchmessers können das Ergebnis verändern. Eine Größenordnung kennen wir hierdurch aber.
- Dieses Experiment verdeutlicht anschaulich, dass wir mit einfachen Mitteln auf sonst kaum zugängliche Größen schließen können.